CRISPR-Cas系统是细菌抵御病毒入侵的关键适应性免疫机制,而噬菌体等可移动遗传元件则进化出多种“反CRISPR”蛋白来对抗这一防御。研究发现,噬菌体可利用一类特殊的RNA分子来干扰CRISPR-Cas系统(RacrIF1)。然而,RacrIF1如何被Cas蛋白识别、如何形成异常复合物并抑制免疫功能的分子细节尚不清晰。
近日,中国科学院物理研究所/北京凝聚态物理国家研究中心软物质与生物物理实验室朱洪涛特聘研究员与中国医学科学院病原与微生物研究所高小攀、崔胜教授,首都医科大学于霞教授合作,首次通过高分辨率冷冻电镜技术阐明了RNA抗I-F型CRISPR系统系统的结构基础与分子机制。
研究团队以I-F型CRISPR-Cas系统为对象,聚焦一类新发现的Racr分子,解析了其在细菌体内如何模拟正常CRISPR RNA的结构,通过“分子诱饵”策略竞争性结合Cas蛋白,从而破坏功能性免疫复合物的形成,最终瓦解细菌的适应性免疫防御。在本研究中,团队利用冷冻电镜技术,成功解析了来自胡萝卜软腐果胶杆菌的I-F型Csy复合物(由蛋白Cas5f,Cas6f,Cas7f,Cas8f组成)及其与RacrIF1分子结合形成的三种异常亚复合物的高分辨结构。结构显示,正常的复合物呈“G”形结构;而RacrI1F1诱导形成的异常复合物则因5′端结构变异,形成含七至九个Cas7f蛋白形成的“C”形或“S”形长丝状组装体。研究还发现,Cas7f在非特异性RNA上可形成近乎无限延伸的超螺旋长丝,提示其在细胞内可能存在严格的调控机制,避免因异常聚合导致自身免疫损伤。该研究不仅首次在原子层面揭示了RacrIF1抑制CRISPR-Cas系统的结构机制,也为理解RNA介导的免疫逃逸策略提供了全新视角。同时,这一发现为发展新型基因编辑调控工具、设计针对CRISPR系统的可控抑制策略提供了理论依据和结构基础。
研究成果于2025年12月30日在线发表于国际权威期刊Molecular Cell,题为RNA anti-CRISPRs deplete Cas proteins to inhibit the CRISPR-Cas system。中国医学科学院病原与微生物研究所崔胜教授,高小攀教授,物理所特聘研究员朱洪涛,首都医科大学于霞教授为共同通讯作者。病原所的高小攀教授,博士生朱凯祥,物理所已出战博士后王琳,首都医科大学博士生张伟贺为文章的共同第一作者。该项工作得到了中国科学院和国家重点研发计划等项目的资助。文章链接https://www.cell.com/molecular-cell/abstract/S1097-2765(25)00979-7。
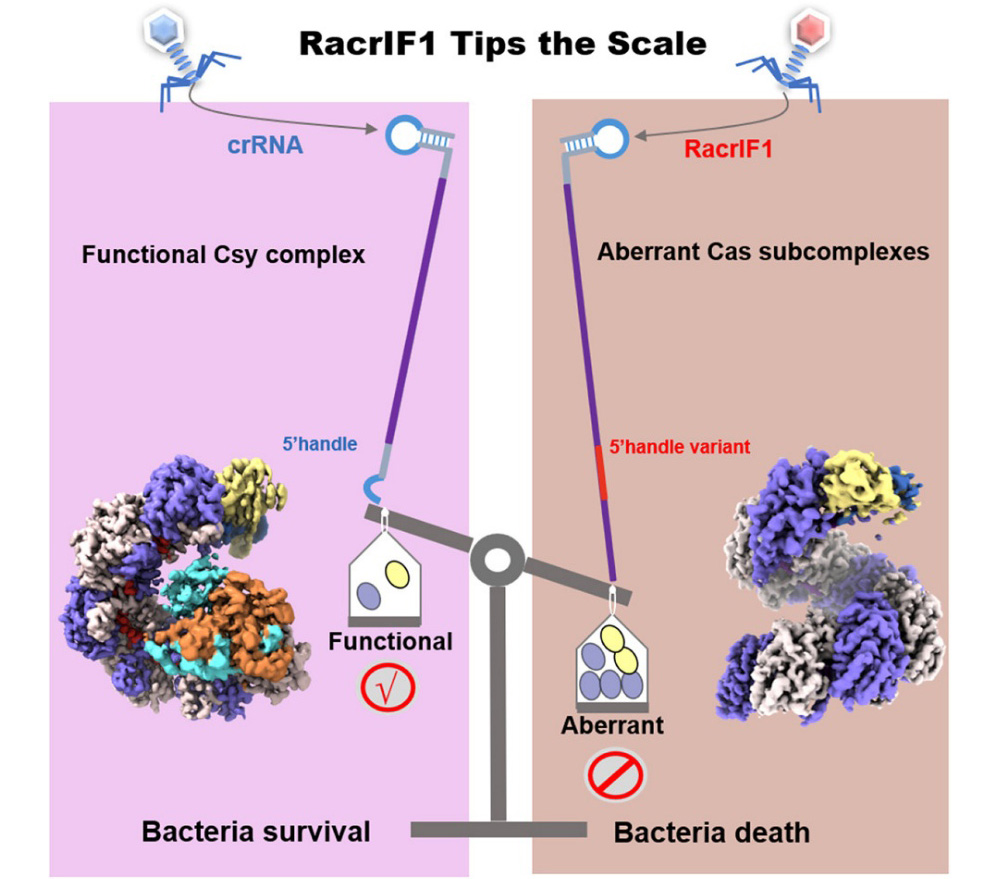
图 噬菌体通过RacrlF1绕过细菌CRISPER-Cas防御系统的分子机理示意图

