2022年5月26日,Biophysical Journal杂志在线报道了中国科学院物理研究所/北京凝聚态物理国家研究中心软物质物理实验室翁羽翔课题组(SM6组)题为“热诱导下α晶状体蛋白发挥分子伴侣功能抑制γD晶状体蛋白在紫外辐照下发生聚集沉淀的分子机制研究(The mechanism for thermal-enhanced chaperone-like activity of α-crystallin against UV irradiation-induced aggregation of γD-crystallin)”的工作。该工作与北京大学人民医院鲍永珍课题组,深圳湾实验室量子生物学高加力课题组合作,应用液相色谱-质谱联用方法(LC-MS),傅里叶变换中红外光谱(FTIR)与脉冲升温(T-jump)纳秒时间分辨中红外瞬态光谱等手段,揭示了在水溶液中热诱导促进α晶状体寡聚体部分解离成单体,通过溶液中的α晶状体单体分子和紫外辐照损伤的γD晶状体单体分子结合,形成αγ异源二聚体。该异源二聚体在生理温度条件下能够自发地组装到部分解离的α晶状体寡聚体上,从而避免了紫外辐照损伤γD晶状体间的聚集,后者的聚集体沉淀对入射光具有强散射效应,是导致白内障的成因之一。 由此提出了α晶状体蛋白抑制紫外辐照损伤γD晶状体蛋白发生聚集沉淀、实现其高效分子伴侣活性并防止紫外辐射导致白内障的分子机制。中科院物理所博士(北京大学深圳研究生院博士后,深圳湾实验室访问学者)李昊为论文的第一作者,翁羽翔和鲍永珍为共同通讯联系人。
白内障是全球首要的致盲性眼病,其中年龄相关性白内障是最主要的类型。随着老龄化进程的加剧和我国庞大的人口基数,随之增加的白内障患者数量对社会和家庭造成巨大的负担,也严重影响老年群体的生活质量。北京大学人民医院鲍永珍课题组在2003年至2005年对中国西部农村地区50岁及以上人群老年性白内障患病率调查结果显示:青海(41.8%)、云南(48.2%)、贵州(18.8%)和广西(39.4%)远高于东部地区的白内障患病率。西南部地区由于海拔较高、纬度较低,紫外线辐射相对较高是造成这一结果的主要原因。紫外线辐照通常被认为是自然衰老过程中引起老年性白内障的主要危险因素,流行病学研究表明了这一观点。
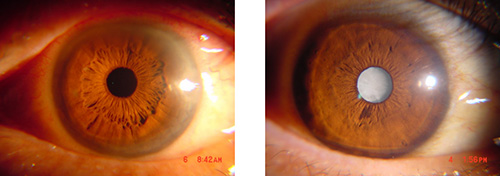
图1. 左图 透明晶状体 右图 混浊晶状体(白内障)
晶状体是眼的主要屈光介质,晶状体混浊即为白内障(图1)。 晶状体的最主要成分是晶状体蛋白。晶状体蛋白包含α、β和γ三大家族, 其中α-晶状体蛋白占50%。α-晶状体蛋白包括2 种亚型:αA( 173 氨基酸残基) 和αB ( 175 氨基酸残基)。正常的晶状体中,晶状体蛋白质分子排列有序,维持着晶状体的高通光性。紫外线、高温、臭氧等因素会引起蛋白质发生不可逆折叠,导致单体状态如γ晶状体蛋白发生聚集。一旦蛋白聚集体形成淀粉样沉淀,晶状体结构的有序性将遭到破坏,进而引发白内障等眼科疾病。α晶状体蛋白在体外通常以30-50个单体聚集而成的寡聚体形式存在,并且在高于生理温度条件下依然能够保持透明性。单体间的结合面的分子结构见图2A,B。α晶状体蛋白作为一种重要的晶状体结构组成蛋白外,还是一种小型热休克蛋白(sHsp),具有分子伴侣的活性,有效抑制其他晶状体蛋白发生损伤后聚集。尽管α晶状体蛋白的分子伴侣活性早在20年前就被发现,但是其中涉及的分子机制却一直没有被揭示。其中的难点是在室温条件下α晶状体处于与其解离而成的单体所构成的动态平衡中,目前尚无法获取α晶状体寡聚体的X-射线晶体结构以及完整的冷冻电镜结构。
作为晶状体的一种结构蛋白,γD晶状体蛋白以单体的形式存在于晶体的内核且含量很高。其结构的热力学稳定性依赖于四个保守的色氨酸(Trp)残基(见图2C)。正常情况下当紫外线到达晶状体时,色氨酸间可以通过快速的能量转移,将光能转化为热能,避免蛋白质分子发生光化学反应。然而,持续的紫外辐照依旧会导致肽链发生光化学裂解,这一光损伤过程也与活性氧有关。
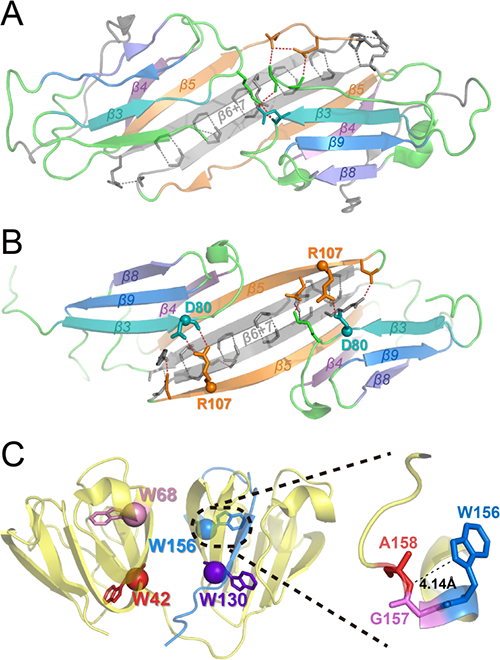
图2. α晶状体蛋白与γD晶状体蛋白结构示意图。(A)和(B)分别是文献报道的αA与αB晶状体蛋白二聚体在中性环境中的冷冻电镜结构示意图。图中用虚线标注二聚体界面处分子间氢键。(B)中重点突出αB晶状体蛋白相邻亚基之间R(Arg)107与D(Asp)80通过侧链形成的氢键。(C)文献报道的γD晶状体蛋白单体结构示意图。图中标注4个保守色氨酸W(Trp),并放大W156-A158附近的蛋白质结构,其中,W156的吲哚环距离A158氨基氮原子的最短距离是4.14Å,该间距下W156自由基可以与A158的肽链发生能量传递。
本项研究首先证实了α晶状体蛋白对紫外辐照(325nm)损伤的γD晶状体蛋白聚集过程具有遏制作用,并且该作用随着温度的升高而增大,如果没有α晶状体的参与,紫外辐照直接导致γD晶状体蛋白变混浊并最终形成沉淀。 随后应用疏水荧光探针分子证实α晶状体蛋白和γD晶状体蛋白的结合面发生在α晶状体蛋白寡聚体热解离后形成的疏水表面,并通过色谱方法在α晶状体蛋白和经紫外辐照损伤γD晶状体的混合物中分离出αγ晶状体异源二聚体,并进一步应用原子力显微镜(AFM)和动态光散射(DLS)方法验证了α晶状体结合紫外损伤后的γD晶状体的复合物(体积大于相同条件下单纯的α晶状体)。同时色谱-质谱联用方法分析表明紫外辐照会造成处于α晶状体蛋白保护下的γD晶状体蛋白在C端Ala158位点发生共价键断裂,掉下一段含15个氨基酸的肽链。
通过变温FTIR和T-jump纳秒时间分辨中红外瞬态光谱对热诱导条件下α晶状体蛋白的四级结构(单体组装成寡聚物的结构)及二级结构(β片层,β弯折,无规卷曲等)进行研究。基于变温中红外光谱,实验发现α晶状体蛋白寡聚物会在热诱导下解离出单体分子,这一过程与二聚体结合界面处分子间氢键的断裂有关,并通过氨基酸单点突变的方法证实了1604 cm-1红外吸收峰来自于二聚体结合界面处分子间氢键,并作为α晶状体热诱导解聚成单体过程的光谱指标。对于变温红外光谱,通过奇异值分解(Single Value Decomposition)方法,将α晶状体蛋白在不同温度区间内的中红外光谱拆分为疏水性不同的三种组分:最外层亲水组分,解离到溶液中的次亲水的单体分子及α晶状体蛋白解离后暴露出的疏水内壳层(图3)。该模型与生物学家提出的疏水性呈梯度分布的三层核壳层模型一致:内核最疏水,第二层次之,最外层最亲水。
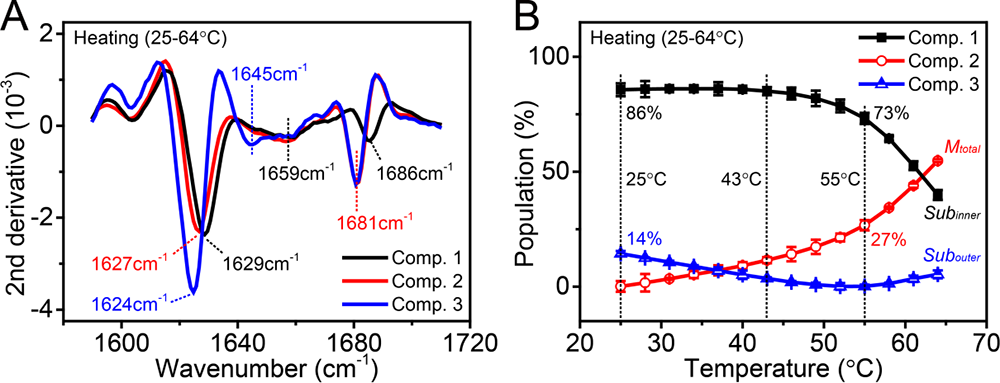
图3. α晶状体蛋白三种不同组分的二阶导数中红外光谱与对应的热滴定曲线。
(A) α晶状体蛋白在25-64℃升温过程中三个组分的二阶导数中红外光谱。包括内层最疏水组分(Component 1)、解离到溶液中的单体(Component 2)、以及外层最亲水的组分(Component 3)。(B) α晶状体蛋白三个组分在不同温度下的布居数。
据此,提出了如图4B所示的α晶状体蛋白抑制紫外光诱导γ晶状体蛋白聚集的分子机制:紫外损伤的γD晶状体蛋白与解离出的α晶状体单体蛋白结合后形成αγ复合物,该复合物又与部分解离的α晶状体蛋白寡聚物重新结合,进而阻止了因γD晶状体蛋白之间聚集而导致的蛋白质沉淀。给出了α晶状体蛋通过热诱导解离成单体发挥其分子伴侣功能,实现对紫外诱导白内障的防护机制。然而α晶状体对紫外辐照损伤γD晶状保护作用是以γD晶状体蛋白C端短肽的被紫外辐照截断为代价的(见图4A)。
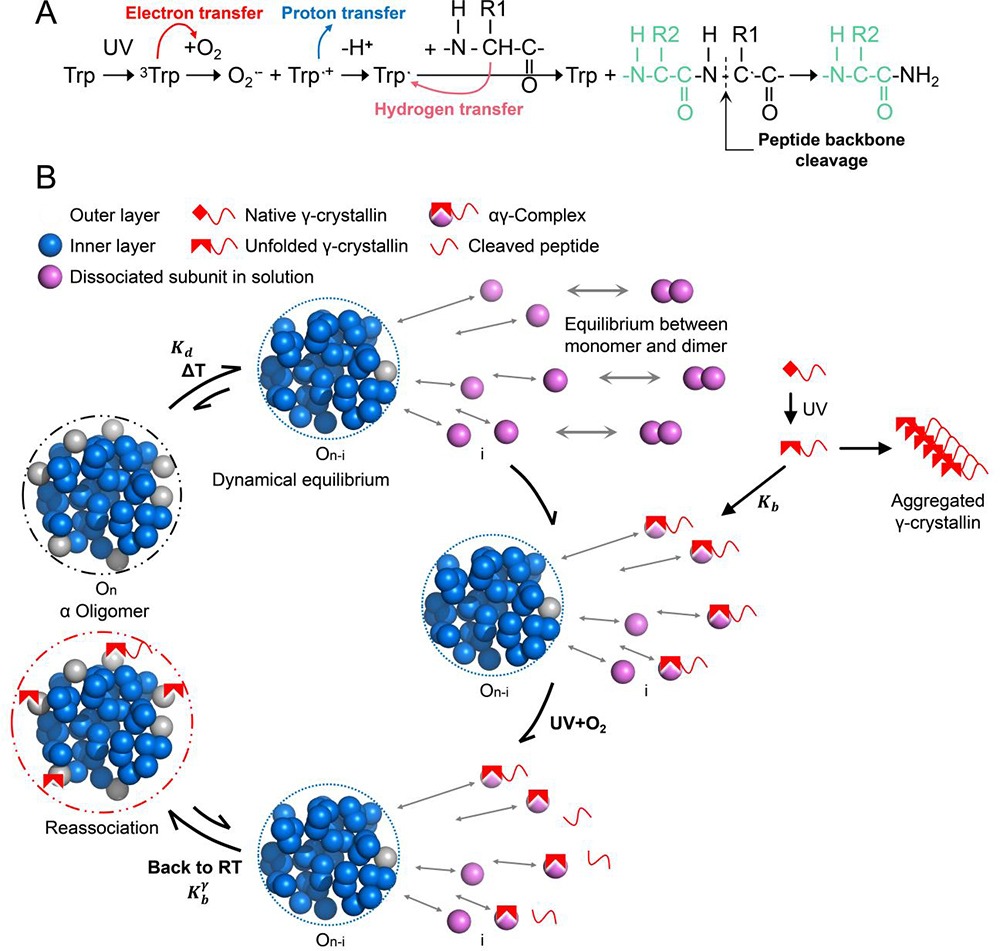
图4. 肽链裂解途径与α晶状体蛋白在热诱导下保护底物γD晶状体蛋白的示意图。(A) 紫外辐照下,在γD晶状体蛋白中由色氨酸(Trp)引发的肽链裂解途径。
(B) 热诱导下α晶状体蛋白分子伴侣活性的机制示意图。该机制发生的温度区间是25-43℃,过程涉及单体脱离(Kd)、α晶状体与D晶状体单体间结合(Kb)及αγ复合物聚集到α晶状体上(\(K_{b}^{\gamma}\))。
中科院物理研究所软物质物理实验室翁羽翔研究组,发展了脉冲升温纳秒时间分辨红外光谱技术,致力于蛋白质动态结构与其生物功能研,在本项工作中,该方法揭示了单体间结合界面分子间氢键断裂及其他二级结构变化的动力学过程。(Biophys. J. 2007, 93, 2756-2766, Rev. Sci. Instr. 86 , 053105,2015)。在以往的工作中,阐明细菌了还原性二硫键异构酶(DsbC) 二聚体参与二硫键氧化通路异常现象的分子机制(Biophysical Journal,97, 2811–2819, 2009); 观测到大肠杆菌DegP热休克蛋白通过“蛋白质地震 (Protein quake) ”模式实现由六聚体到三聚体的解聚动力学过程,阐明了环境温度对激活DegP酶解活性的关键作用(Sci. Rep. 4, 4834-4840,2014);揭示了高等植物光系统II主要捕光天线蛋白色素复合物(Light Harvesting Complex II,LHCII)三聚体,作为蛋白质分子机器,是如何实现高效捕光和光保护功能间可逆切换的机理(Science China-Chemistry 63 , 1121-1133,2020)。
该研究得到了国家自然科学基金委(21433014, 11721404和21173012)和中国科学院(QYZDJ-SSW-SYS017和YJKYYQ20170046)的支持。

